El colágeno, proteína constituyente de los tejidos conjuntivos, como la piel, los tendones y el hueso, es la proteína más abundante del organismo. Se caracteriza principalmente por su notable resistencia: una fibra de 1 mm de diámetro puede soportar una carga de 10 a 40 kg. El colágeno está constituido por un conjunto de tres cadenas polipeptídicas (1000 aminoácidos por cadena), agrupadas en una estructura helicoidal. La glicina constituye la tercera parte de los aminoácidos de cada cadena, hecho único entre todas las proteínas del organismo. La repetición de 333 tripletes de forma Gli-X- Y preside la estructura de cada una de las cadenas. En posición X se encuentra, en la mayoría de los casos, la prolina; en posición Y, se encuentran la hidroxiprolina y la hidroxilisina, dos aminoácidos que no abundan en la constitución de las otras proteínas del organismo.
ESTRUCTURA
ESTRCTURA CUATERNARIA
ESTRUCTURA TERCEARIA
ESTRUCTURA PRIMARIA Y SECUNDARIA
La estructura primaria del colágeno tiene principalmente tres aminoácidos en su mayor proporción: GLICINA,PROLINA e HIDROXIPROLINA.
La primera modificación post-traduccional es una HIDROXILACIÓN, que ocurre sobre ciertos residuos de Prolina y ciertos residuos de Lisina, usualmente en la posición Y.
Los residuos de prolina son específicamente hidroxilados por una prolil hidroxilasa, al igual que ciertos residuos de lisina son hidroxilados en el carbono 5, formando residuos de 5-Hidroxilisina.
La estructura secundaria del colágeno tiene una particularidad: la hélice ya no va a girar hacia la derecha, va a girar hacia la izquierda, y es una hebra, esto ocurre gracias a la prolina y la Hidroxiprolina.
La estructura terciaria se forma cuando las tres hebras se entrecruzan. Tres hebras que tienen giro hacia la izquierda se entrecruzan hacia la derecha. La presencia de glicina, por ser la molécula más pequeña estabiliza las tres hebras lo que llamadas en conjunto tropocolágeno.
La estructura cuaternaria :Las moléculas de tropocolágeno en vez de organizarse en paralelo, se organizan en desfase en cuartos. Es decir que se forma una estructura cuaternaria desfasada aproximadamente ¼ de la longitud de cada molécula. La fibra es tridimensional y tiene forma de cable. Cada Molécula de tropocolágeno se estabiliza para formar la fibra de colágeno mediante enlaces covalentes, los mismos puentes cruzados que se forman intra molecularmente en el tropocolágeno. Los residuos Glicosilados de Hidroxilisina son los que van a dirigir los desfases en cuarto.
Los desfases en cuarto van dejando zonas huecas, y en esas zonas es donde la célula (osteoblasto) va depositando el mineral Hidroxiapatita.


FORMACIÓN DEL COLÁGENO
1) Lectura del ARNm por poli ribosomas del retículo endoplasmático.
2) Ensamblaje de Aminoácidos para la síntesis de procadenas.
3) Hidroxilación de Prolinas y Lisinas que requieren como cofactor ácido ascórbico (vitamina C)
4) Se fija en los grupos de Hidroxilisina, Moléculas de Galactosa y Glucosa (Glucosilación)
5) Se crean puentes Disulfuro e Hidrógeno para la formación de la molécula de PROCOLÁGENO que se encuentra compuesta de una triple hélice.
6) La molécula de PROCOLÁGENO transita por las vesículas de Golgi que se encuentran recubiertas por COP-1, Se realiza empacamiento y la posterior secreción.
7) Bajo la acción de Proteasas se realiza la eliminación de los dominios N-Terminal y C-Terminal, generando así TROPOCOLAGENO
8) Polimerización de moléculas de TROPOCOLÁGENO en disposición escalonada (enlaces entrecruzados covalentes que la Usilo Oxidasa realiza) y así generar FIBRILLAS DE COLÁGENO
9) Incorporación de FIBRILLAS DE COLÁGENO con diferentes tipos de colágeno para la formación de FIBRAS COLÁGENAS.

TIPOS DE COLÁGENOS
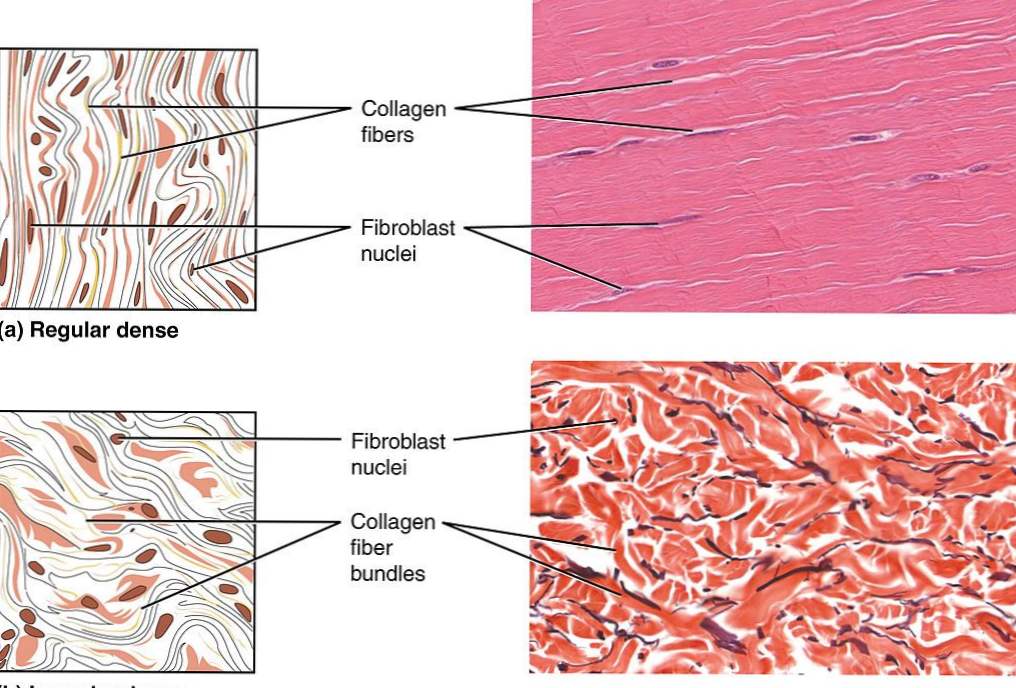
CARACTERÍSTICAS AL MICROSCOPIO
Estos tipos de colágeno van a constituir fibras visibles con el microscopio óptico:
Colágeno tipo I
Colágeno tipo II
Colágeno tipo III
Colágeno tipo V
Colágeno tipo XI
MICROSCOPIO ELECTRÓNICO: Se observan perfectamente las fibrillas. Se pueden ver estriaciones oscuras cada 64- 68 nm. Estas fibrillas tienen un grosor de 0,2 a 0,5 micras de diámetro. Las fibrillas se agrupan en volviéndose por una mucopolisacáridos que formarán las fibras. A su vez, las fibrillas se constituyen por microfibrillas, con un grosor de unos 50 nm, que presentan también la misma estriación que las fibrillas, cada 64-68 nm. membrana (membrana de Henle) constituida a partir de mucopolisacáridos que forman las fibras. A su vez, las fibrillas se constituyen por microfibrillas, con un grosor de unos 50 nm, que presentan también la misma estriación que las fibrillas, cada 64-68 nm.




VAN GIESON
PIEL H & E
HIPOFISIS
CORDÓN UMBILICAL (AZAN)
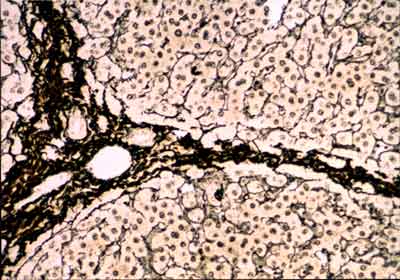
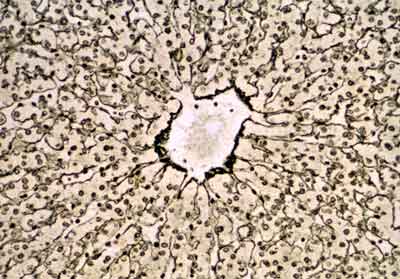
FIBRAS DE RETICULINA
Son fibras muy finas de diámetro menor que las fibras colágenas y se encuentran en el
organismo, formando redes a manera de un retículo.
Propiedades físicas
Son muy similares a las de las fibras colágenas tipo II que se localiza alrededor de diversas estructuras:
- Las células musculares (endomisio).
- Las fibras nerviosas (endoneuro).
- Entre los adipocitos.
- Forma El estroma de muchos örganos glandulares (hígado) y órganos hematolinfopoyéticos (bazo, ganglios linfäticos, médula ósea..).
Son muy resistentes y presentan también birrefringencia uniáxica positiva, que indica una orientación longitudinal de las fibrillas.
Propiedades químicas
Las fibras reticulares no se disuelven con los ácidos diluidos.
Composición química
Su composición química es similar a las fibras colágenas. Además presentan carbohidratos asociados íntimamente a su estructura, aproximadamente 10 veces más que en las fibras colágenas, lo que explica su afinidad por el PAS positivo y son sobre todo argirófilas (elementos que se tiñen con plata y un reductor [técnica gomori de color negro) y las técnicas de impregnación argéntica.
Características estructurales
Debido a la distribución y a sus propiedades tintoriales, se consideró que las fibras reticulares constituían un tipo particular de fibras. Sin embargo, los estudios al M/E demostraron que estaban formadas por fibrillas con la estructura periódica típica del colágeno. Aún cuando los conocimientos actuales demuestran que las fibras colágenas y las reticulares son esencialmente idénticas.
Organización
Se organizan en fibrillas de unas 0,5 micras o menos (s 50 nm), es decir, de pequeño tamaño. Forman unas mallas anastomóticas.
Características tintoriales
Estas fibras no se observan fácilmente al M/O con hematoxilina y eosina, pero sí se tiñen bien con la técnica de PAS y con los métodos de impregnación argéntica. Con esta última las fibras se visualizan con mucha facilidad, por lo que se les denomina también fibras argirófilas. Este tipo de fibra suele localizarse en zonas en que el tejido conjuntivo está en contacto con otros tejidos. Se encuentran alrededor de los vasos sanguíneos, en especial de los capilares, en torno a las fibras musculares y nerviosas, integrando las membranas
basales y formando el retículo de los órganos hematopoyéticos y el estroma de las glándulas endocrinas.
HÍGADO
CORTEZA GANGLIONAR
GANGLIO LINFÁTICO
FIBRAS DE ELASTINA
Son elásticas. Son capaces de deformarse y posteriormente volver a su tamaño original. Son resistentes a la ebullición, pero son muy sensibles a las elastasas.
Se encuentran en el tejido conjuntivo laxo, aunque no tan ampliamente distribuidas en el organismo como las fibras colágenas. Pueden ser sintetizadas principalmente por fibroblastos, condrocitos y células musculares lisas. En estado fresco, las fibras elásticas son ligeramente amarillas, por lo que también se les denomina fibras amarillas. Se localizan preferiblemente en los tejidos que están sometidos a fuerzas expansivas, tales como las arterias, la pleura, la tráquea, los bronquios, los tabiques alveolares, las cuerdas vocales y la piel. En los vasos de mayor calibre, como la aorta, forma extensas láminas u hojas perforadas llamadas membranas fenestradas.
Fase intracelular
Se forman los mensajeros que codifican para las microfibrillas de elastina (en forma de proelastina con telopéptidos terminales) y las de fibrilina. Primero se sintetizan las moléculas de fibrilina y posteriormente se sintetizan las de elastina.
Fase extracelular
La fase extracelular corresponde a la de ensamblaje, y este proceso va marcado por el orden en el cual se produce la exocitosis proteica. Como primeramente se produce la liberación de la fibrilina, ésta se sitúa periféricamente, mientras que como posteriormente se libera la elastina, ésta se sitúa interiormente.
Tipos
Existen 3 grupos principales, pero que realmente son fases de maduración de las fibras elásticas:
Oxitalan: corresponderian a las fibras elásticas más inmaduras, que sólo tienen microfibrillas de fibrilina. Son típicas en la zónula de Zinn (donde se inserta el cristalino), y también en el ligamento del diente (pulpa dentinaria)
Elásticas maduras: Podemos verlas organizadas de formas diferentes.
Se pueden encontrar:
Aisladas y plexos: Suelen localizarse en estructuras muy elásticas como el estroma del pulmón o en la dermis. Fascicular: ligamento amarillo intervertebral.
Láminas: en la pared de la aorta y en otros vasos sanguíneos como en las arterias renales. En algunos de estos vasos, en vez de tener varias láminas tienen dos láminas limitantes: externa e interna.
Morfología.
Forman unas mallas incoloras, pero pueden tener cierta coloración amarilla
Constituyen cilindros o cintillas aplanadas con un diámetro que varía de menos de 1 µm hasta 4 µm, aunque en algunos ligamentos llegan a alcanzar hasta 10-12 µm.
Propiedades físicas
Son más refringentes (brillantes) que las fibras colágenas, propiedad que sirve para identificarlos microscópicamente.
Propiedades químicas
Es uno de los elementos del organismo más resistente a la ebullición y a los ácidos álcalis débiles y es digerida enzimáticamente por la elastasa, enzima que se obtiene del páncreas.
Composición química
Desde el punto de vista químico puede considerarse como un polipéptido semejante al colágeno en su contenido en glicina y prolina, pero que difiere por su alto contenido de valina.
Características tintoriales
Las fibras elásticas poseen intensa acidofilia, pero no siempre se tiñen bien con la H/E, por lo que a veces se dificulta su identificación con esta técnica. Existen métodos especiales para la tinción de las fibras elásticas, tales como la orceína (pardo) y la fucsina-resorcina (azul intenso a púrpura).
Características estructurales
Los estudios al M/E demostraron que estas fibras carecen de una estructura molecular periódica y que en ella se distinguen dos componentes: microfibrillas tubulares con diámetros de 13 nm y asociadas a estas, Otros componente amorfo que constituye una masa central de elastina. En el desarrollo de las fibras elásticas aparecen primero las microfibrillas y después el componente amorfo. Se describen dos tipos de fibras elásticas cuyo desarrollo se ha detenido. En la piel existen fibra elásticas en que predominan las microfibrillas en lugar de
la elastina y en los tendones fibras elásticas que sólo poseen microfibrillas.
Microscópio óptico
Las fibras elásticas no se colorean con hematoxilina-eosina. Se realizan coloraciones específicas. El colorante más utilizado es la orceína (se tiñe en color rojo pardo) y con fucsinas diferentes (tiñen de color rojo). Las fibras se disponen en forma de mallas bifurcadas y son fibras mucho más pequeñas de diámetro 0,2 micras. Estas fibras, con microscopio de luz polarizada, no se observa refringencia en el interior.
Microscopio electrónico
Con microscopio de alta resolución se ha podido observar recientemente que las fibras elásticas tienen dos tipos de microfibrillas: Microfibrillas de fibrilina: 10 nm de diámetro, que son cadenas polipeptídicas de secuencias no repetitivas. Intervienen la desmosina y la isodesmosina, que son 2 aminoácidos. Microfibrillas de elastina: de 2 a 4 nm. La elastina se denominaba material amorfo. Generalmente, las microfibrillas de fibrilina se disponen en la periferia y las de elastina se disponen en el centro. Puede quedar atrapada alguna microfibrilla de fibrilina en el centro.
CARTILAGO ELASTICO




No hay comentarios:
Publicar un comentario